|
|
氢化铝锂 |
| CAS No.: |
16853-85-3 |
| 分子式: |
LiAlH4 |
| 分子量: |
37.95 |
| 备注: |
中文名称氢化铝锂中文同义词氢化锂铝;(T-4)-四氢铝酸锂;氢化锂铝;四氢化铝锂;四氢铝锂;氢化铝锂四氢呋喃溶液;氢化锂铝:四氢锂铝;氢化锂铝(LAH)英文名称LithiumAluminumHydride英文同义词Aluminate(1-),tetrahydro-,lithium;Aluminate(1-),tetrahydro-,lithium,(T-4)-;Aluminumlithiumhydride;LiAlH4;Lithiumaluminohydride;Lithiumaluminumtetrahydride;Lithiumtetrahydroaluminate(1-);lithiumaluminumhydride,etherealCAS号16853-85-3分子式LiAlH4分子量37.954298EINECS号240-877-9相关类别稀有金属;催化和无机化学;铝锂;有机锂;无机化合物;锂铝试剂;还原剂,氢化物;锂;有机锂化合物;添加剂;医药、农药及染料中间体;化学试剂-还原剂;金属催化剂Mol文件16853-85-3.mol结构式氢化铝锂性质熔点125°C(dec.)(lit.)沸点0°C密度0.97g/mLat20°C闪点99°F储存条件Storebelow+30°C.溶解度与H2O、乙醇反应;四氢呋喃形态片状(每片约0.5克)颜色白色至浅灰色比重0.917气味(Odor)无味固体水溶解性Reacts敏感性Air&MoistureSensitive水解敏感性8:reactsrapidlywithmoisture,water,proticsolventsMerck14,350暴露限值TLV-TWA2mg(Al)/m3(ACGIH).稳定性稳定的。与水剧烈反应,放出氢气。与强氧化剂、醇类、酸类不相容。CAS数据库16853-85-3(CASDataBaseReference)NIST化学物质信息Lithiumtetrahydroaluminate(16853-85-3)EPA化学物质信息Lithiumaluminumhydride(16853-85-3)氢化铝锂用途与合成方法简介氢化铝锂是有机化学中一个常用的还原试剂,能够还原多种官能团化合物;同时也能作用于双键和三键化合物实现氢铝化反应;另外氢化铝锂还能作为碱参与反应。例如:将LiAlH4与2mol的乙醇反应,即生成氢化二乙氧基铝锂[LiAlH2(OC2H5)2];与3mol的叔丁醇反应,生成三叔丁氧基铝锂LiAlH[OC(CH3)3]3。氢化铝锂具有很强的氢转移能力,能够将醛、酮、酯、内酯、羧酸、酸酐和环氧化物还原为醇,或者将酰胺、亚胺离子、腈和脂肪族硝基化合物转换为对应的胺。此外,氢化铝锂超强的还原能力使得可以作用于其它官能团,如将卤代烷烃还原为烷烃。该类反应中,卤代物的活性从大到小依次是碘代物、溴代物和氯代物。氢化铝锂的固体和溶液都具有高度可燃性,必须隔绝空气、湿气,并最好在氮气氛下保存。物化性质本品为金属复合氢化物(配离子型氢化物)。纯品氢化铝锂为微晶白色粉末。当有金属铝杂质存在时为灰色粉末。单斜晶系。相对分子质量37.95。比重0.917。熔点大于120℃。在干燥空气中在室温下稳定,在125℃分解,生成氢化锂、铝和氢,从120℃开Chemicalbook始缓慢释放氢气。在潮湿空气中水解并引起燃烧。可溶解于乙醚、四氢呋喃等有机溶剂中。应用氢化铝锂为无机金属化合物,在医药、香料、农药、染料及其他精细有机合成中用作还原剂。制备称取241.43g的六水氯化铝和42.41g的氯化锂,加水溶解,加入一定量的碳酸钠溶液,待沉淀完全后,静置抽滤,固体干燥后经500-600℃的高温煅烧分解4小时后得氧化物,氧化物在高压釜中,并加入CaH2为催化剂,在180℃和20kg/cm2氢压下固体加氢4-5小时后得铝锂混合单质。在有机溶剂四氢呋喃中加入催化剂萘和TiCl4,通入氢气常温常压下氢化4-5小时,可得四氢化铝锂产物。淬灭方法氢化锂铝粉末很细,戴口罩!使用过的称量纸和钢勺注意处理!反应结束加溶剂后用甲醇破坏过量的四氢铝锂后用稀盐酸洗涤,但是乳化,很多絮状固体用硅藻土都很难滤去,后用稀碳酸氢钠洗涤也是乳化。1.比较好的方法是低温下用水淬灭生成胶体状颗粒,过滤,然后再用溶剂洗涤几次,合并有机相,洗涤,干燥,浓缩即可。2.低温用水淬灭,然后加大量硫酸镁,形成小颗粒,再过滤就容易的多了。如果反应小可以试试。3.反应完毕后,计量加水,后加硫酸镁干燥,抽滤即可!4.最好用NaOH溶液淬灭,然后过滤脱溶。假设反应的氢化铝锂(LiAlH4)用量为1g。反应完成后,将反应混合物冷却至-10~0℃,搅拌下,缓慢滴加1mL的水淬灭反应。完毕,再缓慢滴加1mL的10%NaOH溶液。滤除产生的固体,用反应溶剂洗涤数次,滤液减压浓缩即得产品。必要时,固体可用乙醇或甲醇浸泡洗涤,浓缩回收更多的产品(此时多半含无机盐)。一般固体悬浮于反应溶剂中,非常容易过滤。有时在加水过程中,反应物较为粘稠,可适当加入一些反应溶剂稀释。注意:加水时反应较剧烈,大量放热且有气体产生,一定要缓慢滴加。水和NaOH的次序不要加反,否则可能会加重对产物的吸附而影响产率。化学性质氢化铝锂亦称“氢化锂铝”、“四氢铝锂”。化学式LiAlH4。分子量37.95。白色结晶性粉末。相对密度0.917,熔点125℃(分解)。对湿气和含质子的溶剂极为敏感,迅速反应并放出氢气。遇水立即发生爆发性的猛烈反应并放出氢气,故对湿气需要十分小心。加氨分解。溶于乙醚、四氢呋喃和二甲基乙二醇醚,微溶于二丁醚,不溶于二噁烷。对有机化合物具有一定空间选择性反应。具有很强的还原能力,能还原:四氯化硅、锡的有机卤化物、羰基化合物、羧酸、腈类等分别制得甲硅烷或乙硅烷、锡烷、羟基化合物、伯醇、伯胺等。能同金属卤化物或非金属卤化物发生交换反应。用途用作测定羰基的试剂、还原剂,也用于氢化物、硅烷、硼烷等的制备用途用作聚合催化剂、还原剂、喷气发动机燃料,也用于合成药物。氢化铝锂具有极强的还原剂。可将醛、酮、酸、酸酐、酯、内酯、醌、酰氯等还原为醇,将腈还原为伯胺,将卤代烃还原为烃。但通常不能使碳-碳双键氢化。广泛应用于医药、香料、农药、染料及其他精细有机合成中的还原剂。生产方法氢化铝锂可由氢化锂与无水三氯化铝在乙醚中作用或用碱金属氢化物与铝和氢在烃或醚中相互作用而制得。类别遇水燃烧物品毒性分级中毒爆炸物危险特性与氧化剂混合可爆可燃性危险特性高温、遇水、酸、氧化剂放出氢气可燃储运特性库房通风低温干燥;与氧化剂、强酸分开存放灭火剂干粉、干砂、石粉职业标准TWA2毫克(AL)/立方米 |
| 结构式: |
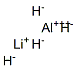 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|