|
|
氯乙烯 |
| CAS No.: |
75-01-4 |
| 分子式: |
C2H3Cl |
| 分子量: |
62.5 |
| 备注: |
中文名称氯乙烯中文同义词氯乙烯/甲醇溶液;氯乙烯标准溶液;氯乙烯溶液;氯乙烯标准品;氯乙炔;氯乙烯;未标记氯乙烯50UG/ML甲醇溶液;氯乙烯(13C2,99%)+氢醌英文名称VINYLCHLORIDE英文同义词vinylchloridecylinderwith2L~1.6kgnet;VINYLCHLORIDE,1X1ML,MEOH,200UG/ML;VINYLCHLORIDZYLINDER7LMITNETTO;VINYLCHLORIDE,1X1ML,MEOH2000UG/ML;VINYLCHLORIDE,99.5+%;VINYLCHLORIDE200UGMLINMETHANOL;vinylchloridesolution;acetylenechlorideCAS号75-01-4分子式C2H3Cl分子量62.5EINECS号200-831-0相关类别原料药;合成试剂;微生物;挥发性有机化合物(VOCs);特种气体;有机合成中间体;化工;DWS高纯气体;试剂盒-Elisa试剂盒;Vinylchloride;refrigerants;PHARMACEUTICALS;ChloroGasoline,Diesel,&Petroleum;OlefinsCosmetics;OtherAdditivesVolatiles/Semivolatiles;Allergens;AlphaSort;Alphabetic;ChemicalClass;Halogenated;Oeko-TexStandard100;Substanceclasses;T-ZAnalyticalStandards;VMethodSpecific;VolatileEmissionsMore...Close...Mol文件75-01-4.mol结构式氯乙烯性质熔点-153.8°C(lit.)沸点-13.4°C(lit.)密度0.911g/mLat25°C(lit.)蒸气压3,428at30°C(quoted,Standen,1964)折射率n20/D1.3700(lit.)闪点-78°F储存条件2-8°C溶解度丙酮/二硫化碳、MEK、THF:可溶形态粉末水溶解性<1.1g/L(25ºC)Merck13,10055Henry’sLawConstant1.50,1.68,2.17,2.65,and2.8at10,15,20,25,and30°C,respectively(EPICS,Ashworthetal.,1988)暴露限值TLV-TWA5ppm(~12.5mg/m3)(ACGIH),1ppm(OSHA),200ppm(MSHA),LowestDetectionLimit(NIOSH);ceiling5ppm/15min(OSHA);carcinogenicity:RecognizedHumanCarcinogen(ACGIH),AnimalSuf-ficientEvidence,HumanSufficientEvidence(IARC),CancerSuspectAgent(OSHA).介电常数3.3(Ambient)稳定性稳定,但可能对光敏感。可能发生自动聚合。与强氧化剂、化学活性金属、铜不相容。高度易燃。浓度约为3%时有严重的爆炸风险。据报道,“这种材料的大火几乎是无法扑灭的”。CAS数据库75-01-4(CASDataBaseReference)(IARC)致癌物分类1(Vol.Sup7,97,100F)2012EPA化学物质信息Vinylchloride(75-01-4)氯乙烯用途与合成方法概述氯乙烯,又称乙烯基氯,结构式H2C=CHCl。常温下为无色有麻醉作用易液化的气体,微溶于水,能溶于醇、醚。与空气形成爆炸性混和物,爆炸极限3.6~26.4%(体积)。有光或催化剂存在时,易发生聚合,亦能与丁二烯、丙烯腈、醋酸乙烯和丙烯酸甲酯等共聚,共聚产物可以制得各种性能的树脂,加工成管材、板材、薄膜、塑料地板、各种压塑制品、建筑材料、涂料和合成纤维等。常用的制备方法主要有电石乙炔法、乙烷法和乙烯氧氯化法,其中乙烯氧氯化法是目前世界上生产氯乙烯最主要的方法。同时,氯乙烯是制备聚氯乙烯及其共聚物的单体。也常称为氯乙烯单体,在世界上是与乙烯和氢氧化钠等并列的最重要的化工产品之一。药品概况名称:氯乙烯又名:乙烯基氯英文名:vinylchloride,chloroethylene化学式:CH2=CHCl,C2H3Cl分子量:62.50理化性质常温常压下为无色气体。有醚样气味。易燃。相对分子质量62.50。相对密度0.9106。熔点-153.8℃。沸点-13.37℃。折射率1.3700。临界温度156.5℃。临界压力5.6728MPa:闪点-78℃(闭式)。燃点472℃。蒸气压(×103Pa):52.929(-28.4℃)、163.320(-1.6℃)、198.78(4℃)、403.57(25.7℃)。微溶于水(体积分数,%)0℃时0.81、10℃时0.57、20℃时0.29,溶于乙醇、乙醚和丙酮。与空气组成爆炸混合物,爆炸极限3.6%~26.4%(体积分数)。在光、热、偶氮化合物、过氧化物等引发剂的作用下,可以悬浮聚合、乳液聚合、本体聚合和溶液聚合。难以发生取代反应。但在四氢呋喃中,可与镁形成格氏试剂:CH2=CHCl+Mg→CH2=CHMgCl可以与丙烯酸、丙烯腈、丁二烯、乙烯、异丁烯、丙烯、苯乙烯、乙酸乙烯、丙烯酸酯、甲基丙烯酸酯等共聚。加成反应发生在双键,可与氯、氯化氢、硫化氢、二氯乙烷、硒、酰氯等加成。能进行缩合反应,生成氯丁二烯。能进行取代反应,与醇钠反应,生成烯醚,与乙酸反应,生成乙酸乙烯酯。与氟化氢反应,可发生卤素置换,生成氟乙烯。本品有毒,有麻醉性,对神经系统、肝、肾有毒害作用。制备方法世界上氯乙烯的生产技术主要电石乙炔法、乙烯法、乙炔-乙烯法和乙烷法。1.电石乙炔法a.基本原理:乙炔和氯化氢在以氯化汞为活性组分、以活性炭为载体的催化剂上气相反应生成氯乙烯。乙炔来源:CaO+3C→CaC2+COCaC2+2H2O→Ca(OH)2+CH≡CH主反应:CH≡CH+HCl→H2C=CHCl主要副反应:CH≡CH+2HCl→CH3-CHCl2CH≡CH+H2O→CH3-CHO反应机理:(1)乙炔先与氯化汞发生加成反应,生成中间产物氯乙烯氯汞CH≡CH+HgCl2→ClCH=CH-HgCl(2)氯乙烯氯汞不稳定,和氯化氢反应生成氯乙烯ClCH=CH-HgCl+HCl→CH2-CHCl+HgClb.工艺:目前乙炔法合成氯乙烯主要采用列管式固定床反应器。反应管径为57mm,管壁厚度为3.5mm,内装有平均尺寸为φ3×6mm的条状HgCl2/AC催化剂。乙炔与经过石墨冷凝器的氯化氢气体按一定比例在混合器中混合后进入石墨冷凝器中,用-35℃盐水间接冷却到-14℃左右,Chemicalbook进入酸雾捕集器,用硅油玻璃棉捕集酸雾使之生成盐酸,放入盐酸贮槽。除去酸雾的干燥混合气体进入预热器,由流量计控制从上部进入串联转化器组。后台反应器排出的粗氯乙烯气体在高温下带出的氯化汞在填充活性炭的除汞器中除去,然后进入石墨冷凝器,用0℃水间接冷却到15℃以下再进入泡沫塔,回收过量的氯化氢以制取30%以上的盐酸放入酸贮槽。2.乙烯法(1)直接氯化:乙烯直接氯化是一个简单的不饱和双键加成反应,工艺有在溶剂中进行反应的液相法,也有在气相中进行的气相法。气相法一般以Fe、Al、Ca等氯化物为催化剂,液相法以二氯乙烷(EDC)为溶剂,催化剂一般为FeCl3。工业上一般以液相法居多。a.反应原理:直接氯化反应为气-液非均相反应,催化剂为FeCl3。通常催化剂溶解在EDC液相中,乙烯气和氯气自反应器底部通入,在EDC液相层中反应生成EDC。该反应为放热反应,反应式如下:主反应:C2H4+Cl2→C2H4Cl2(EDC)+200.64kJ/mol副反应:C2H4Cl2(EDC)+Cl2→CH2Cl-CHCl2+HClC2H4+HCl→C2H5Clb.工艺:液相法工艺按反应温度可分为低温氯化、中温氯化和高温氯化3种工艺,它们的主要区别在于反应过程中大量反应热的利用和产品的提纯过程。一般将反应温度在50℃左右的工艺称低温法,其特点是液相氯化液相出料,由于液相EDC中带有催化剂,需不断补充催化剂;生成的EDC需水洗,因而产生大量废水;反应热需庞大的外循环冷却设备导出。中温氯化技术氯化温度约90℃,液相氯化气相出料;生成的EDC不需水洗,只需经脱轻、脱重即可供裂解使用;直接氯化尾气可作氧氯化反应原料气。高温氯化工艺的反应温度约110~120℃,特点是产品纯度高,生成EDC不需水洗、脱轻、脱重,利用反应热精馏后即可供裂解使用,流程简单,节能效果显著。(2)乙烯氧氯化a.基本原理:乙烯氧氯化生成二氯乙烷及其裂解的反应式为:C2H4Cl2→C2H3Cl+HCl这个方法称叫二步法,是现在工业上生产氯乙烯广泛应用的方法。b.工艺:二步法是以乙烯、氯气、氧(或空气)为原料以氯化铜为催化剂制取氯乙烯的方法。目前工业上采用的乙烯氧氯化方法包括下述工序:①乙烯加氯直接氯化制取二氯乙烷;②二氯乙烷精制;③二氯乙烷热解制氯乙烯。催化剂用CuCl2负载在γ-Al2O3上,以纯净的乙烯、氯化氢和空气作原料,在固定床或沸腾床中进行。反应热相当大,必须适当予以移去,以免过热生成高级多氯化物。提高原料气中的氧浓度,可以减少排放尾气量和净化尾气工作量。乙烯氧氯化技术的发展除了催化剂的改进和工艺条件的改进之外近年来对用纯氧代替空气作氧化剂的纯氧法氧氯化推崇者甚多。其主要优点是环境污染小,消耗低和操作弹性大。3.乙炔-乙烯法乙炔法氯乙烯工艺流程较短,技术较成熟,但生产能力相对较小。虽然乙烯法氯乙烯工艺流程较长,但具有许多乙炔法氯乙烯工艺不具备的优点,该路线以混合的稀乙炔-乙烯为原料(两者都是轻油裂解的产物),成本较低。此法是以乙烯和乙快同时为原料进行联合生产,它是以下列反应为基础的:C2H4+Cl2→C2H4ClC2H4Cl→C2H3Cl+HClC2H2+HCl→C2H3Cl原料气先在催化反应器中与氯化氢气体反应,使乙炔转化成为氯乙烯单体,后者以二氯乙烷洗涤回收。余下来的进料气基本上不含乙炔成分,即可通入氯化反应器,使乙烯与氯气反应成为二氯乙烷。氯化反应在氧化铁催化剂及二氯乙烷溶剂存在下进行。这一路线具有的特点:不需乙炔-乙烯分离、净化装置;杂质较少;整个流程中只需用一种溶剂等特点。因此氯乙烯单体生产成本较其他方法为低。4.乙烷法将饱和碳氢化合物在不稳定的温度范围内,例如在1000℃下与氯气反应,可生成相当量的氯乙烯。反应式为:C2H6+2Cl2→C2H3Cl+3HCl首先,工艺的关键是研制开发出一种新型催化剂,可降低反应温度,减轻设备腐蚀并减少副产物的生成量,副产的氯代烃可转化成氯乙烯单体(VCM),提高乙烷的转化率;另外,该新工艺将乙烷和氯气一步反应转化为VCM,仅使用1个反应器;由于不以乙烯为原料,所以VCM的生产不必依赖乙烯裂解装置。其次,该工艺的关键之处是氧氯化反应器。送入的乙烷与再循环的氯化氢混合,并与氧气(或富含氧气的空气)和来自这个工艺中另一处的饱和氯化烃一起,导入到流化床反应器底部,反应生成VCM。注意事项长期吸入高浓度氯乙烯可引起头痛、头晕、乏力、记忆力减退、四肢酸痛、多汗、雷诺氏症、肝脾肿大伴有肝功能异常,有的可出现硬皮病样改变及指(趾)端溶骨症。工人中肝血管肉瘤和肝癌发病率增高。氯乙烯已确定为人类致癌物。预防重点是设备和管道的密闭化,聚合釜内层加涂料减少清釜次数,清釜前先抽风或灌水排去剩留的氯乙烯,必要时应佩带送风防毒面具。我国车间空气中最高容许浓度为30mg/m3。以上关于氯乙烯的理化性质,制备方法等信息由Chemicalbook的丁编辑整理。应用1.用作合成聚氯乙烯,也用作冷冻剂等。聚氯乙烯广泛用于工业管材、板材、管件、薄膜、绝缘材料、纺织材料的原料;2.也用作香料、染料的萃取剂;3.本品与其他单体的共聚物可以制得各种性能的树脂,加工成管材、板材、薄膜、塑料地板、各种压塑制品、建筑材料、涂料和合成纤维等。化学性质无色易液化气体。具有醚臭。微溶于水。水中溶解度(%,体积):0℃0.81;10℃0.57;20℃0.29。溶于乙醇、乙醚、四氯化碳、苯。用途用作多种聚合物的共聚单体用途塑料工业的重要原料,主要用于生产聚氯乙烯树脂。与醋酸乙烯、偏氯乙烯、丁二烯、丙烯腈、丙烯酸酯类及其他单体共聚生成共聚物,也可用作冷冻剂等。生产方法1.乙烯氧氯化法该法是世界公认为技术经济较合理的方法。乙烯与氯气在三氯化铁催化剂存在下,液相直接氯化生成1,2-二氯乙烷。1,2-二氯乙烷经精制后裂解,得氯乙烯和氯化氢,经精馏得到成品氯乙烯。副产氯化氢、乙烯与空气,通过载于氧化铝上的氯化铜触媒进行氧氯化反应得1,2-二氯乙烷,精制后在500℃、2.0-2.5MPa压力下,在管式炉内裂解生成氯乙烯和氯化氢,精制得产品氯乙烯。副产品氯化氢可再返回氧氯化反应器与乙烯再进行氧氯化反应。2.乙炔气相合成法本法工艺简单,产品纯度高,但耗电量大,成本高,并有汞污染问题。由电石发生的乙炔与氯化氢混合,在氯化汞存在下,于170-190℃进行反应,反应产物经水洗、碱洗、压缩、全凝、初馏、精馏,得氯乙烯单体。3.乙烯直接氯化法4.烯炔联合法类别有害气体毒性分级中毒急性毒性吸入-大鼠LC50:18000PPM/15分;口服-大鼠LD50:500毫克/公斤爆炸物危险特性与空气混合明火、受热可爆可燃性危险特性明火、受热可燃;燃烧产生有毒氯化物烟雾储运特性库房通风低温干燥;轻装轻卸;与氧气、空气等助燃气体钢瓶分开存放灭火剂雾状水、二氧化碳、泡沫职业标准TWA10毫克/立方米;STEL30毫克/立方米 |
| 结构式: |
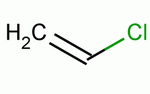 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|