|
|
碳酸锂 |
| CAS No.: |
554-13-2 |
| 分子式: |
Li2CO3 |
| 分子量: |
73.89 |
| 备注: |
中文名称碳酸锂中文同义词高纯碳酸锂;酸锂;碳酸锂(纳米);碳酸锂1KG;高纯级碳酸锂;工业级碳酸锂;微粉级碳酸锂;碳酸锂(工业)英文名称Lithiumcarbonate英文同义词Camcolit;Candamide;Carbolith;Carbolithium;Carbolitium;Carbonicacidlithiumsalt(Li2CO3);Ceglution;CP15467-61CAS号554-13-2分子式CLi2O3分子量73.89EINECS号209-062-5相关类别Cd硝酸盐;无机化工产品;无机盐;无机化合物和盐;生化试剂;高纯碳酸锂;锂;通用试剂;催化和无机化学;轻金属;化学试剂;试剂;有机化工原料;metalcarbonate;Aliphatics;LithiumSalts;MaterialsScience;MetalandCeramicScience;化工产品-有机化工;生化试剂-其他化学试剂;香精香料;碳酸盐;其他原料;材料中间体及助剂;化工原料;功能性添加剂化工原料;特种材料;无机化工原料;化工材料;锂盐;精细化工原料;氟化物;碳酸盐;进口原料;助剂中间体;化工;高纯光谱纯试剂;医用;无机化学;InorganicChemicals;Inorganics;InorganicBasesMetalandCeramicScience;ChemicalSynthesis;LithiumSalts;Salts;SyntheticReagents;InorganicBases;AnalyticalReagents;AtomicAbsorptionSpectroscopy(AAS);DigestionReagents;PureSaltsforMeltingDigestions(TraceSELECT)Analytical/Chromatography;TraceAnalysisReagents;ACSGradeChemicalSynthesis;EssentialChemicals;RoutineReagents;E-L,Purissp.a.ACSStainsandDyes;AnalyticalReagentsforGeneralUse;J-K-L;Purissp.a.ACS;Stains&Dyes,Ato;MetalandCeramicScience;Intermediates&FineChemicals;PharmaceuticalsMol文件554-13-2.mol结构式碳酸锂性质熔点720°C沸点1342°C(lit.)密度2.11g/mLat25°C闪点1310°C储存条件Storeat+5°Cto+30°C.溶解度13克/升酸度系数(pKa)pKa6.38(Uncertain);10.25(Uncertain)形态金属丝状比重2.11颜色白色气味(Odor)无味PH值10-11(5g/l,H2O,20℃)水溶解性13g/L(20ºC)Merck14,5527Ksp沉淀平衡常数pKsp:1.6BRN3999191BCSClass1InChIKeyXGZVUEUWXADBQD-UHFFFAOYSA-LLogP-0.809(est)CAS数据库554-13-2(CASDataBaseReference)NIST化学物质信息Lithiumcarbonate(554-13-2)EPA化学物质信息Lithiumcarbonate(554-13-2)碳酸锂用途与合成方法概述碳酸锂(分子结构式Li2CO3,英文lithiumcarbonate)为无色单斜晶体或白色粉末。密度2.11。熔点618℃。无潮解性,在空气中是稳定的。在水中的溶解度很小,溶解度随温度的升高而降低。在冷水中的溶解度较热水为大。溶于稀酸,不溶于乙醇和丙酮。将二氧化碳通入碳酸锂的水悬浮液中时,碳酸锂即转变为酸式碳酸锂而溶解。如果再将酸式碳酸锂的溶液加热,则又放出二氧化碳,并沉淀出碳酸锂。碳酸锂的这个性质可用于除去其中的杂质。由于锂离子具有很强的极化性,因此碳酸锂的热稳定性比其他碱金属碳酸盐要差一些,加热到熔点以上时,便会发生分解,产生氧化锂和二氧化碳。碳酸锂行业是一个全球高度垄断行业,目前产能主要集中在SQM、FMC、Chemetall等三家国外厂商手中。工业上碳酸锂用于制造其他锂盐,如氯化锂和溴化锂等。它还在搪瓷、玻璃、陶瓷和瓷釉中作为氧化锂的原料,也被加到电解制铝的电解槽中,用以增加电流效率Chemicalbook和降低电解槽的内阻和槽温。在医药上主要用于治疗躁狂症,对精神分裂症能改善其情感障碍。有升高外周白细胞作用。制备从工业级碳酸锂提纯电池级碳酸锂的方法如下:称取20g工业级Li2CO3,倒入600ml烧杯中,量取200ml去离子水加入,并不断搅拌混合成均匀的Li2CO3浆料。量取甲酸20ml,倒入分液漏斗中,调节使甲酸逐滴加入持续匀速搅拌的Li2CO3浆料中,得到可溶性澄清溶液。称取20g尿素,用50ml去离子水溶解,倒入上述澄清溶液中,将混合液体放入水浴锅,调节温度80℃,称取5g氢氧化锂溶于80ml去离子水中,用滴管加入调节混合液体pH在10左右,并不断搅拌,反应5h,取出抽滤得到白色沉淀,并用去离子水反复清洗、抽滤4次,得到固体放100℃烘箱中烘烤35小时,得到白色粉末状碳酸锂产品。治疗精神疾病发现历程碳酸锂在精神科临床的应用其实相当偶然。1940年初,氯化锂曾代替氯化钠用于高血压和心脏病患者,以降低钠离子的摄入量;后因其毒性作用而于1949年放弃使用。1949年,澳大利亚医生约翰·凯德(JohnCade)在研究躁郁症的成因时估计它与尿酸有关,不过由于尿酸在水中的溶解性很小,难以进行动物实验,而尿酸锂是最易溶于水的尿酸盐,于是他就用尿酸锂来进行实验。结果发现,接受过尿酸锂的动物都变得十分温驯和安静,攻击行为得到控制。经过进一步研究,他发现尿酸锂中的锂离子才是关键所在,于是他便进一步进行实验,并在期刊上发表文章《锂治疗精神兴奋》,正式将锂引入精神科临床用于躁狂症的治疗。水中溶解度(g/100ml)不同温度(℃)时每100毫升水中的溶解克数:1.54g/0℃;1.43g/10℃;1.33g/20℃;1.26g/30℃;1.17g/40℃;1.08g/50℃1.01g/60℃;0.85g/80℃;0.72g/100℃毒性参见碳酸锂。毒性具有明显的刺激作用,首先对胃肠道、肾脏和中枢神经系统有损害。锂化物的毒性顺序为Li<LiCl<Li2CO3最高容许浓度:锂的冷凝和碎裂气溶胶分别为0.05mg/m3和0.5mg/m3。工作时应穿戴橡皮手套和防护面具,注意防尘,以保护呼吸器官。化学性质白色单斜晶系粉末。微溶于水(0℃时1.54;100℃时0.72),不溶于醇,溶于酸。用途用于锂化合物及搪瓷、玻璃制造,医药上用作治疗狂躁抑郁性精神病药物用途是制取锂化合物和金属锂的原料。可作铝冶炼的电解浴添加剂。在玻璃、陶瓷、医药和食品等工业中应用广泛,亦可用于合成橡胶、染料、半导体及军事国防工业等方面。用途用于半导体、电视机、原子能、陶瓷、医药、催化剂等部门,也用于制取锂化合物用途主要用于制作钽酸锂、铌酸锂等声学级单晶、光学级单晶等用途用于制取声学级单晶,光学级单晶。也是制取高纯锂化合物和金属锂的原料。用途用于治疗狂燥性精神病,制作镇静剂等。用途电池级碳酸锂主要用于制备钴酸锂、锰酸锂、三元材料及磷酸铁锂等锂离子电池正极材料。用途高纯级碳酸锂主要应用于制备高端锂离子电池正极材料及电池级氟化锂的制备;在光电信息方面,高纯级碳酸锂用于制备钽酸锂和铌酸锂;同时高纯级碳酸锂还应用于光学特种玻璃、磁性材料行业及超级电容器、医药行业等。用途制取各种高纯锂盐的原料;含锂单晶的原材料;用于光学特种玻璃、搪瓷工业、医药、催化剂、彩色荧光粉;锂离子电池材料生产方法沉淀法以精制一水氢氧化锂为原料,加入盛有无离子水的反应器中,在搅拌下缓慢加入碳酸钠进行反应生成碳酸锂沉淀,用无离子水漂洗,再经离心分离,干燥得高纯碳酸锂。其反应如下:2LiOH+Na2CO3→Li2CO3+2NaOH生产方法卤水综合利用法卤水经提取氯化钡后的含锂料液加入纯碱以除去料液内钙、镁离子,加入盐酸酸化,蒸发去除氯化钠,再经除铁,然后加入过量纯碱使碳酸锂沉淀,经水洗、离心分离、干燥,制得碳酸锂成品。其2LiCl+Na2CO3→Li2CO3+2NaCl石灰烧结法锂辉石精矿(一般含氧化锂6%)和石灰石按1:(2.5~3)重量比配料。混合磨细,在1150~1250℃下烧结生成铝酸锂和硅酸钙,经湿磨粉碎,用洗液浸出氢氧化锂,经沉降过滤,滤渣返回或洗涤除渣,浸出液经蒸发浓缩,然后加入碳酸钠生成碳酸锂,再经离心分离、干燥,制得碳酸锂成品。其Li2O·A12O3·4SiO2+8CaO→Li20·Al2O3+4[2CaO·SiO2]Li2O·A12O3+Ca(OH)2+Nh2o→2LiOH+CaO·A12O3+Nh2o2LiOH+Na2CO3→Li2CO3+2NaOH |
| 结构式: |
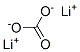 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|