|
|
碘 |
| CAS No.: |
7553-56-2 |
| 分子式: |
I2 |
| 分子量: |
253.81 |
| 备注: |
中文名称碘中文同义词碘,99.8%,ACSREAGENT;碘粒;碘(AR);碘标准溶液(0.05000MOL/L(0.1N));碘标准溶液(1000ΜG/ML,溶剂:水);碘溶液(0.1M,溶液组成为THF:吡啶:H2O=78:20:2);碘溶液(0.02M,溶液组成为THF:吡啶:H2O=89.6:0.4:10);碘溶液(0.05M,溶液组成为THF:H2O:吡啶=70:20:10)英文名称Iodine英文同义词IodineFlakes,99.998%;Iodine,Resublimed,99.5%;Iodine(Resublimed)ExtraPure;Iodine,99+%;NLT99,5%orrefined;Iodinespheres,ultradry,-60mesh,99.999%(metalsbasis);Iodine,0.1Nstandardsolution;Iodine,foranalysisACS,99.8+%CAS号7553-56-2分子式I2分子量253.81EINECS号231-442-4相关类别化学试剂;原料药;滴定标准品;电子化学品;容量分析滴定液;无机单元素标准溶液;单质;食品添加剂;生化试剂;固体单质;中间体;合成试剂;卤代物;Cv电子工业用无机化工;无机化工产品;无机盐;Ci碘;C-X键形成;诊断试剂;标准品和标准物质;生物化学;无机化合物和盐;专业试剂;化工原料;无机化工原料-单质;其他生化试剂;无机化工原料;无机化工;化工中间体;医用原料;基础原料;医药化学品;主营产品;原料;医药原料;添加剂;有机中间体;所有产品;抗病毒类中间体;Inorganics;ElectronicChemicals;Micro/Nanoelectronics;PureElements;ACSGradeSyntheticReagents;C-XBondFormation(Halogen);EssentialChemicals;Iodination;RoutineReagents;SyntheticReagents;IodinationMicro/Nanoelectronics;IodinationEssentialChemicals;ReagentPlus;IodinationPharmacopoeia(USP);PharmacopoeialAntibiotics;PharmacopoeiaA-ZPharmacopoeia(USP);AnalyticalReagentsforGeneralUse;E-L,Purissp.a.ACS;Purissp.a.ACS;PharmaceuticalIntermediates;pharmaceutical;日用化学品;化工;农用中间体;7553-56-2;其他Mol文件7553-56-2.mol结构式碘性质熔点113°C(lit.)沸点184°C(lit.)密度1.32g/mLat25°C蒸气密度9(vsair)蒸气压0.31mmHg(25°C)闪点<10℃储存条件StoreatRT.溶解度与氯仿、四氯化碳、二硫化碳、环己烷、甲醇、乙酸乙酯、甲苯、苯、正己烷、丁二醇、溴乙烷、正庚烷、甘油和乙醚混溶。形态颗粒(圆形)颜色棕红色比重4.93气味(Odor)尖锐的特征气味PH值5.4(H2O)(saturatedsolution)电阻率(resistivity)1.3E15μΩ-cm水溶解性0.3g/L(20ºC)晶体结构RhombicMerck14,5014BRN3587194暴露限值Ceiling0.1ppm(~1mg/m3)(ACGIH,MSHA,OSHA,andNIOSH);IDLH10ppm(NIOSH).InChIKeyPNDPGZBMCMUPRI-UHFFFAOYSA-NLogP2.49at20℃CAS数据库7553-56-2(CASDataBaseReference)NIST化学物质信息Iodine(7553-56-2)EPA化学物质信息Iodine(7553-56-2)碘用途与合成方法卤族元素碘是继氯之后被发现的第二个卤族元素,单质碘是元素周期表第Ⅶ主族元素,属非金属元素,符号Ⅰ。原子序数为53,原子量为126.9044,其放射性核素有123碘、125碘、131碘等,电子组态为2,8,18,18,7,相对密度为4.93,熔点为113.5℃,沸点为184℃。化合物中碘常见的氧化态为-Ⅰ(碘化物),+Ⅴ(碘酸盐),+Ⅶ(高碘酸盐)。碘为紫黑色闪亮晶体,能缓慢升华,气态碘显紫色,有刺激性气味,有毒!1811年法国化学家B.库尔特瓦发现从焙烧海草中提取碳酸钾后,往剩余的母液中加入硫酸加热时有蓝紫色蒸气,冷凝为灿烂的片状结晶,阐明了碘的物理性质。后经H.戴维和J.L.盖吕萨克研究,给予肯定是新元素,J.L.盖吕萨克将它命名为iodine,来源于希腊文ioeides,原意为“紫色的”。碘在地壳中含量为3×10-5%。海水中含少量碘离子I-,1t海水中含50mg,海藻中常含有很多碘,但主要来源于智利硝石,碘以NaIO3,Ca(IO3)2形式存在。碘具有金属的特征,已知有磷酸碘、高氯酸碘、醋酸碘等盐,电解醋酸碘溶液时,碘在阴极上析出,证明碘带正电荷。碘易溶于有机溶剂,在不同极性溶剂内始终为双原子分子,如在四氯化碳、三氯甲烷和乙烷内,溶液颜色为紫色与气态碘相同,若溶于极性较高的溶剂,如水内,则显淡棕色,在乙醇内,溶解较多显棕色。溶液颜色不同,是由于溶剂分子以配位键与碘结合发生溶剂化作用的结果。在非极性溶剂或低极性溶剂内,不发生溶剂化作用,故溶液颜色与碘蒸气相同。碘微溶于水,但很快发生水解,溶液显弱酸性,有碱存在时可促使水解,由于次碘酸盐很不稳定,又歧化分解为碘酸盐和碘化物。以上信息由Chemicalbook的晓楠编辑整理。化学性质碘不能直接与碳、氮或氧化合;与臭氧反应生成氧化物;与氟、氯、溴等反应,分别生成氟化物、氯化物及溴化物,与氨反应生成爆炸性的三碘化氮;在有水分存在时,与磷反应生成三碘化磷及四碘化二磷;与铂只能在高温下反应;与锆反应生成挥发性的四碘化锆;与其他多种金属可在常温反应,形成不挥发碘化物。碘在酸性溶液中是氧化剂,可氧化亚硫酸盐、重亚硫酸盐、硫代硫酸盐、亚砷酸盐、亚锡酸盐为硫酸盐、连四硫酸盐、砷酸盐及锡酸盐。强氧化剂可使碘氧化成碘酸或碘酸盐。碘与二氧化硫在无水甲醇与吡啶的混合液中不反应,但如有水分存在,二氧化硫即被氧化为硫酸,碘被还原为碘化氢。碘遇淀粉显蓝色。与饱和烃作用,在有氧化铅或碘酸存在时,碘可取代其中的氢;与不饱和烃作用,可在双键处加成,形成多碘化物。在水溶液中,碘的氧化性比氯和溴弱得多,只有强还原剂氢硫酸和硫代硫酸钠才能将它还原成碘离子:(1)I2+H2S=S+2HI(2)I2+2S2O2-3=S4O2-6+2I-,后一反应在分析化学中可用来定量碘,是碘量法的基础。在水溶液中,氯能将碘氧化为碘酸,在碱性溶液中,过量氯可将碘氧化为高碘酸盐。浓硝酸也能将碘氧化成碘酸。除贵金属外,碘可与所有金属化合成碘化物,与非金属化合成共价型碘化物,与其他卤素作用,生成卤素互化物,如溴化碘、氯化碘、氟化碘等。碘离子为强还原剂,易给出一个电子。碘离子无色,但空气中的氧能将碘离子氧化成游离的碘,而使碘化物溶液略带棕色。单质碘遇淀粉生成蓝色物质,这是定性鉴定碘的特效方法,蓝色是淀粉与碘形成的配合物所致,其中(I3—I2)长链阴离子外部围绕直链淀粉螺旋形物。自然界存在的唯一碘同位素就是稳定的碘-127,其放射性同位素是碘-131,医学上用它治疗甲状线癌,还可用来标记许多化合物,供诊断体内或体外疾病用。自然界分布及生态学碘在自然界分布广泛,以化合物形式存在。岩石、土壤、水、动植物和空气中都含有微量碘。但除海水外,碘在自然界的分布极不平衡。环境中的碘以化合物形式存在,碘的化合物大都溶于水而随水的流动而转移。降水的冲刷淋滤作用带走土壤中的碘并流进江、河、湖,最终汇入大海,所以,海水含碘最为丰富和稳定,碘浓度为50~60μg/L,有“碘库”之称。由于蒸发作用,海水中的一部分碘进入空气,每年约有40万t碘进入大气。这些碘以雨(雪)水形式降至陆地上,这就是碘在自然界的循环。火山岩土壤含碘量高达到9.0mg/kg,地质倾斜角度较大的地区、内陆地区和经冰水冲刷后形成的土壤中含碘量低,沿海地区和岛屿上的土壤内含碘量高。生物从大自然中获取碘,经浓集后的碘浓度一般要高于自然环境中的碘浓度。人体必须的微量元素碘是人体必须的微量元素之一,是维持人体正常新陈代谢所不可缺少的物质,成人体内约含有20~50mg,分布在肌肉、甲状腺、皮肤、骨骼、中枢神经系统及血浆中。碘是合成甲状腺激素的主要原料,甲状腺组织含碘占体内总碘量的20%左右(约8mg),碘在体内用于合成甲状腺分泌的含碘激素(即甲状腺素),因此碘的生理功能是通过甲状腺素的作用体现出来的。甲状腺素可活化100多种酶,促进蛋白质合成,促进生长发育和智力的发展,维持正常精神状态、新陈代谢、身体形态等等。人体缺碘时,甲状腺呈代偿性肥大,可引起地方性甲状腺肿大;胎儿期缺碘可引起呆小病,故孕妇应适当补充碘,多吃海产品,如海带、紫菜等。目前我国推广食盐中加碘,加入量控制在1:20000至1:50000之间,以预防缺碘疾病;患者甲状腺缺碘性肿大者可口服碘制剂;甲状腺危象时用碘剂治疗可迅速改善症状;甲状腺机能亢进手术时,术前可适当应用;碘制剂亦可用于治疗某些眼病,促进渗出物吸收等;亦可制成造影剂,用于泌尿系统逆行造影及胆管造影;碘酒广用于皮肤消毒灭菌用;碘仿用于粘膜深在伤口的处Chemicalbook理;碘苷具有抗病毒作用。总之,碘是人体及医药中十分重要的元素。但摄入碘过多亦可引起高碘性甲状腺肿大。中国营养学会1988年建议碘的每日供给量为成人150μg,孕妇加25μg,乳母加50μg。膳食中含碘量与土壤含碘量关系密切。一般高原地区的沙质土壤含碘很少;粘土地区不易透水,含碘量相对丰富。海水中含碘多,沿海地区土壤中含碘量亦高。富含碘的食品有海带、紫菜、淡菜等海产品。甲状腺肿未必是日粮缺碘的反映。可能是由于存在着干扰甲状腺激素合成的称为促甲状腺肿的物质。如十字花科植物中的含硫化合物(异硫氰酸酯)和其他来源的高氯酸盐会抑制甲状腺集中碘化物;硫脲和硫脲嘧啶因含有巯基(—SH),干扰碘化物氧化成游离的元素碘而影响甲状腺激素的合成,都能造成类似缺碘的后果,但补充碘不能完全治愈此种甲状腺肿。食物来源碘在生物界的循环经历了三个过程:植物从土壤和水摄取碘,故植物的碘含量一般高于外环境,这是碘的一级浓集;动物吃了植物,使动物体的碘含量高于植物,这是碘的二级浓集;人再进食动物和植物,这是碘的三级浓集。食物碘含量的高低一般遵循以下原则。海产品的碘含量大于陆地食物:鉴于大海是自然界的碘库,故海洋生物内的含碘量很高。含碘最高的食物为海产品,如:海带、紫菜、鲜海鱼、蚶干、蛤干、干贝、淡菜、海参、海蜇、龙虾等;海带含碘量最高,干海带中可达到240mg/kg以上;其次为海贝类及鲜海鱼(800μg/kg左右)。但是,盐中含碘量极微,越是精制盐含碘越少,海盐中的含碘量低于5mg/kg,若每人每日摄入10g盐,则只能获得低于50μg的碘,远不能满足预防碘缺乏病的需要。动物性食物的碘含量大于植物性食物:陆地食品则以蛋、奶含碘量较高(40~90μg/kg),其次为肉类,淡水鱼的含碘量低于肉类。植物的含碘量是最低的,特别是水果和蔬菜。参考资料:中国营养学会编著;中国达能营养中心协编.中国居民膳食营养素参考摄入量.碘的吸收与排出人体碘的来源如下:80%~90%来自食物,10%~20%来自饮水,不足5%的碘来自空气。消化道、皮肤、呼吸道、黏膜均可吸收碘。食物中的碘有两种形式:无机碘和有机碘。无机碘(碘化物)在胃和小肠几乎100%被吸收。有机碘在消化道被消化、脱碘后,以无机碘形式被吸收。与氨基酸结合的碘可直接被吸收。很少量的小分子有机碘可以被直接吸收入血,但绝大多数在肝脏脱碘。只有同脂肪酸相结合的有机碘可不经肝脏,而由乳糜管吸收而进入体液。胃肠道内的钙、氟、镁阻碍碘的吸收,在碘缺乏的条件下尤为显著。人体蛋白质与能量不足时,会妨碍胃肠内的碘吸收。在碘供应稳定和充足的条件下,人体排出的碘几乎等于摄入的碘。肾脏是碘排出的主要途径,尿碘来自血碘,占碘总排出量的80%以上(其中90%以上为无机碘,10%以下为有机碘)。粪中的碘主要是未被吸收的有机碘,占总排出量的10%左右。肺及皮肤排出的碘少,但大量出汗时可达到总排出量的30%。妇女的乳腺从血浆中浓集的碘随乳汁排出,哺乳妇女每日可因哺乳至少丧失30μg的碘,随着婴儿的生长和泌乳量的增加,通过乳腺丢失的碘量也会大大增多,这可能是哺乳妇女易发生甲状腺肿的一个原因。消毒防腐药碘有强大的杀菌作用,可杀灭细菌芽孢、真菌、病毒、原虫。碘主要以分子(I2)形式发挥杀菌作用,其原理主要是碘化和氧化菌体蛋白的活性基团,并与蛋白的氨基结合而导致蛋白质变性和抑制菌体的代谢酶系统。碘在水中的溶解度很小,但在有碘化物存在时,因形成可溶性的三碘化合物,其溶解度增高数百倍,又能降低其挥发性。据此,在配制碘溶液时,常加适量的碘化钾,以促进碘在水中的溶解。在碘水溶液中具有杀菌作用的成分为元素碘(I2)、三碘化物的离子(I3-)和次碘酸(HIO),其中HIO的量较少,但杀菌作用最强;I2次之;解离的I3-的杀菌作用极微弱。在酸性条件下,游离碘增多,杀菌作用较强;在碱性条件下,反之。碘酊是常用最有效的皮肤消毒药。一般皮肤消毒用2%碘酊,手术部位消毒用5%碘酊。由于碘对组织有较强的刺激性,其强度与浓度成正比,故碘酊涂抹皮肤待稍干后,宜用75%乙醇擦去,以免引起发疱、脱皮和皮炎。碘甘油刺激性较小,用于黏膜表面消毒。2%碘溶液不含乙醇,适用于皮肤浅表破损和创面,以防止细菌感染。在紧急情况下用于饮水消毒,每升水中加入2%碘酊5~6滴,15分钟后可供饮用,水无不良气味,且水中各种致病菌、原虫和其他生物可被杀死。毒性碘蒸气强烈刺激眼睛、皮肤和呼吸器官,长时间接触碘或吸入碘蒸气,可引起咳嗽、流鼻涕、流泪、发烧、头痛、结膜炎、腮腺肿大、支气管炎、鼻炎、复视、皮肤红斑、皮肤黏膜出现水泡。重者则发生呕吐、腹泻、尿中出现蛋白和血红蛋白。碘蒸气中毒时,应立即离开现场,到室外呼吸新鲜空气,吸入5%硫代硫酸钠或2%碳酸氢钠溶液;再用2%碳酸氢钠溶液洗涤鼻、口、喉部;眼痛时,可用水冲洗,并滴入2~3滴盐酸可卡因。碘溅到皮肤上,立即用硫代硫酸钠溶液洗除;经过口腔中毒时,应迅速饮服淀粉糊、牛乳、牛奶、鸡蛋或稀硫代硫酸钠水溶液。空气中碘的最高容许浓度为1mg/m3。生产设备要求密闭,生产环境要通风良好,在工作时必须穿戴密闭防护眼镜,长统胶靴、乳胶手套、防毒面具及工作服。毒性碘蒸气强烈刺激眼睛、皮肤和呼吸器官,长时间接触碘或吸入碘蒸气,可引起咳嗽、流鼻涕。流泪、发烧、头痛、结膜炎、腮腺肿大、支气管炎、鼻炎、复视、皮肤红斑,皮肤黏膜出现水泡。重者则发生呕吐、腹泻、尿中出现蛋白和血红蛋白。碘蒸气中毒时,应立即离开现场,到室外呼吸新鲜空气,吸入5%硫代硫酸钠或2%碳酸氢钠溶液;再用2%碳酸氢钠溶液洗涤鼻、口、喉部;眼痛时,可用纯水洗涤,并滴入2~3滴盐酸可卡因。碘溅到皮肤上时,应立即用硫代硫酸钠溶液洗除;经过口腔中毒时,应迅速饮服淀粉糊、牛乳、牛奶、鸡蛋或稀硫代硫酸钠水溶液。空气中碘的最高容许浓度为lmg/m3。生产设备要求密闭,生产环境要通风良好。工人在工作时必须穿戴密闭防护眼镜、长统胶靴、橡皮围裙、乳胶手套、防毒面具及工作服。食品添加剂最大允许使用量最大允许残留量标准▼▲添加剂中文名称允许使用该种添加剂的食品中文名称添加剂功能最大允许使用量(g/kg)最大允许残留量(g/kg)碘运动营养食品营养强化剂22.5-100μg化学性质带有金属光泽的紫黑色鳞晶或片晶。性脆,蒸气呈紫色。具有特殊刺激臭。微溶于水,溶解度随温度升高而增加;难溶于硫酸;易溶于有机溶剂;碘也易溶于氯化物、溴化物;更易溶于碘化物溶液;可溶解硫、硒、铵和碱金属碘化物、铝、锡、钛等金属碘化物。用途主要用于制造碘化物,也用于制备农药、饲料添加剂、染料、碘酒、试纸、药物等用途电子工业用材料,用作高纯试剂。用途用于容量分析及比色分析用途医药上主要用作消毒剂用途是制造无机碘化物和有机碘化物的基本原料,主要用于医药卫生方面,用以制造各种碘制剂、杀菌剂、消毒剂、脱臭剂、镇痛剂和放射性物质的解毒剂。是制农药的原料,亦是家畜饲料添加剂。工业上用于合成染料、烟雾灭火剂、照相感光乳剂和切削油乳剂的抑菌剂。用于制造电子仪器的单晶棱镜、光学仪器的偏光镜、能透过红外线的玻璃。用于皮革和特种肥皂。在有机合成反应的甲基化、异构化和脱氢反应中,碘是良好的催化剂。还用作烷烃和烯烃的分离剂。用作松香、妥尔油及其他木材制品的稳定剂。也用作高纯度锆、钛、铪、硅和锗的提炼剂。用途消毒、杀菌。用途主要用于制造碘化物,用于制造农药、饲料添加剂、染料、碘酒、试纸、药物等用于配制当量溶剂、测定碘价、标定硫代硫酸钠溶液浓度,溶液可作消毒剂,照相制版中用于碘剂和减薄液配制用途标定硫代硫酸钠标准溶液,测定油脂的碘值,镁及乙酸盐的显色反应,制造碘烷及碘化物等。淀粉的比色测定。测定血清中非蛋白氮、淀粉酶。制备固紫和甲苯胺蓝碘溶液。催化剂。消毒剂。生产方法离子交换法将海带加13~15倍量的水浸泡两遍,浸泡液含碘量达0.5~0.55g/L。因浸泡液含有大量褐藻糖胶和其他杂质,需加碱除去,加入36%~40%液碱,经充分搅拌,使Ph为12,澄清8h以上。上部清液送至酸化槽,加入盐酸调节Ph在1.5~2,然后送入氧化罐,通氯气进行氧化使碘游离,通过717#离子交换树脂吸附,加入亚硫酸钠解吸,把得到含碘解吸液加入氯酸钾、硫酸后使碘析出,将粗碘加热至150℃以上,加入浓硫酸进行熔融精制,经冷却结晶、粉碎,制得碘成品。其2I-+Cl2→12+2Cl-SO32-+I2+H2O→SO42-+2H++2I-C1O3-+6I-+6H^+>→3I2+3H2O+Cl->通过离子交换柱的废碘水用以提取甘露醇。空气吹出法将含碘制盐母液加入盐酸进行酸化,控制Ph在1~2,经预热至40℃左右,送入氧化器,同时通入适量氯气,使料液中的碘离子氧化为碘分子,将此氧化液送至吹出塔,从上部均匀淋下,从吹出塔下部通人预热至40℃的空气,将碘吹出,含碘空气进入吸收塔,由塔上部喷淋下的二氧化硫水溶液吸收,并被还原生成氢碘酸。当吸收液浓度达到含碘约150g/L时,即送人碘析器,在不断搅动下,缓慢通入氯气,使碘游离沉淀,经过滤、加入浓硫酸熔融精制,冷却结晶、粉碎,制得碘成品。其2I-+C12→I2+2CI-I2+SO2+2H2O→2HI+H2SO42HI+C12→12+2HCl生产方法以工业碘为原料,经重结晶提纯精制而成,制得高纯碘纯度为99.5%。类别易燃液体毒性分级低毒急性毒性口服-大鼠LD50:14000毫克/公斤;口服-小鼠LD50:22000毫克/公斤爆炸物危险特性水溶液有腐蚀性可燃性危险特性与还原剂反应;高温产生有毒烟雾;燃烧产生有毒碘化物烟雾储运特性库房通风低温干燥;与氧化剂分开储运灭火剂水、砂土职业标准TWA1毫克/立方米;STEL2毫克/立方米 |
| 结构式: |
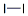 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|