|
|
单水氢氧化锂 |
| CAS No.: |
1310-66-3 |
| 分子式: |
HLiO |
| 分子量: |
23.95 |
| 备注: |
中文名称单水氢氧化锂中文同义词一水合氢氧化锂(氢氧化锂);氢氧化锂,一水,ACS,≥98.0%;氢氧化锂,一水,AR,98%;氢氧化锂,一水,GR,≥99.0%(T);氢氧化锂,一水;氢氧化锂水合物;氢氧化锂一水合物;氢氧化锂单水合物英文名称Lithiumhydroxidemonohydrate英文同义词Lithiumhydroxidehydrate;LITHIUMHYDROXIDE-1-HYDRATE;MonohydrateLithiumHydroxide;Lithiumhydroxidemonohydrate99.95%tracemetalsbasis;Lithiumhydroxidemonohydrate99.995%tracemetalsbasis;LithiumhydroxidemonohydrateACSreagent,>=98.0%;Lithiumhydroxidemonohydratepuriss.p.a.,>=99.0%(T);Lithiumhydroxidemonohydratepurum,>=98.5%CAS号1310-66-3分子式Li.HO.H2O分子量41.96EINECS号603-454-3相关类别微生物;无机化合物和盐;氢氧化锂;Cs氢氧化物;无机化工产品;无机盐;化工原料;其他生化试剂;通用试剂;锂;信息化学品;催化和无机化学;化学试剂;LithiumSalts;MetalandCeramicScience;Salts;AnalyticalReagentsforGeneralUse;I-N,Purissp.a.;Purissp.a.;ACSGradeChemicalSynthesis;EssentialChemicals;InorganicBases;RoutineReagents;稀有金属;生化试剂;氢氧化物;材料中间体及助剂;化工;原料;有机原料;锂盐;医药原料;有机中间体;氢氧化物;化工品;其他中间体;其他原料;无机原料;医用原料;SyntheticReagents;ChemicalSynthesis;metalhydroxideMol文件1310-66-3.mol结构式单水氢氧化锂性质熔点462°C沸点920°C密度1.51储存条件Storeatroomtemperature.溶解度H2O:1Mat20°C,透明,无色形态固体比重1.51颜色白色至奶油色或黄色气味(Odor)无味PH值~12(25℃,1MinH2O)酸碱指示剂变色ph值范围14水溶解性109g/L(20ºC)最大波长(λmax)λ:260nmAmax:0.02λ:280nmAmax:0.02敏感性AirSensitive&HygroscopicMerck14,5534稳定性稳定的。与水分不相容。强酸、二氧化碳。会吸收空气中的二氧化碳。InChIKeyWMFOQBRAJBCJND-UHFFFAOYSA-MCAS数据库1310-66-3(CASDataBaseReference)NIST化学物质信息LiOH(1310-66-3)EPA化学物质信息Lithiumhydroxide(Li(OH)),monohydrate(1310-66-3)单水氢氧化锂用途与合成方法简介氢氧化锂是一种强碱,化学性质与元素周期表中的第2族氢氧化物更为相似,而与第1族氢氧化物有较大差别。其为白色四方系晶体,对皮肤有强烈的腐蚀性和刺激性,熔点450℃,相对密度1.46。分解温度924℃。微溶于乙醇,溶于水,但溶解度低于其他碱金属的氢氧化物。在空气中吸湿后或在水溶液中结晶时均得到单水氢氧化锂。与二氧化硫、氯化氢、氰化氢等酸性气体反应。也能与强酸或弱酸在水溶液中完全反应。在空气中吸收二氧化碳生成碳酸锂。应用氢氧化锂用作润滑脂添加剂(增稠剂、防氧化剂、极压剂),可提高耐热性、耐水性、稳定性和机械特性,可用于汽车、飞机、起重机等的轴承;用作锂电池的电解质原料。经过焙烧后的固体氢氧化锂可用作宇宙飞船、潜艇等乘务人员的二氧化碳吸收剂,美国早期的水星、双子星座和阿波罗计划和航天飞机均采用氢氧化锂吸收剂,性能可靠Chemicalbook,在含有水汽的气体中可以很容易地吸收二氧化碳。其化学反应式为:2LiOH+CO2→Li2CO3+H2O,1g无水氢氧化锂可吸收450ml二氧化碳,一人一日只需750g就足以将呼出的二氧化碳全部吸收。此外,氢氧化锂还广泛用于制备其他锂的化合物和锂盐的原料,及锂皂、锂基润滑脂、醇酸树脂、光谱分析的展开剂、碱性蓄电池中添加剂、照相显影剂及催化剂等。它作为碱性蓄电池电解质的添加剂,可增加电容量12%~15%,提高使用寿命2~3倍。以上信息由ChemicalBook王晓楠编辑整理发展历史1944年开始使用无水氢氧化锂,作潜水艇中的二氧化碳吸收剂,用氢化锂作军用气球的充气源。1950年同位素6Li用作生产氢弹等热核武器的原料,美国原子能工业开始大量使用氢氧化锂,使锂工业获得惊人的发展。锂及锂化物因其独特的化学和物理性质而广泛用于军事工业和民用工业。电解铝工业是锂的最大用户。铝电解中添加碳酸锂,可降低电解质熔点,提高铝电解槽的电流效率,从而使铝产量增加约10%,电耗降低8~14%;此外,还可以抑制22%~38%的有害氟排出。在美国和欧洲,铝工业消耗的碳酸锂量约占锂总量的40%。化学反应1,氢氧化锂在隔绝空气情况下,加温至600℃时,生成氧化锂和水,化学反应方程式:2LiOH=Li2O+H2O。2,在加温条件下,氢氧化锂与镁或钙作用,均生成金属锂和相应的氧化物。(1)2LiOH+Mg=2Li+MgO+H2O(2)2LiOH+Ca=2Li+CaO+H2O3,氢氧化锂与氯或碘作用,均生成卤化锂和次卤酸锂。(1)2LiOH+Cl2=LiCl+LiOCl+H2O(2)2LiOH+I2=LiI+LiOI+H2O4,氢氧化锂与锌作用,形成锌酸锂和氢气,化学反应方程式:2LiOH+Zn=LiZnO2+H2。5,氢氧化锂与酸发生中和反应,生成相应酸的锂盐(或水合锂盐)和水。(1)LiOH+HBO2+7H2O=LiBO2·8H2O(2)2LiOH+H3PO4=Li2HPO4+2H2O(3)2LiOH+H2SO4=Li2SO4+2H2O(4)LiOH(过量)+HClO4=LiClO4+H2O6,氢氧化锂与氯化铵和四碘合汞(Ⅱ)酸锂的混合液、氯化钙或氯化钡作用,均能生成氯化锂。(1)4LiOH+2Li2HgI4+NH4Cl=LiCl+7LiI+Ohg2NH2I+3H2O(2)2LiOH+CaCl2=2LiCl+Ca(OH)2(3)2LiOH+BaCl2=2LiCl+Ba(OH)2制备方法以碳酸锂为原料,与氢氧化钙反应,可以制得单水氢氧化锂。在此反应中,由于两种原料的溶解度都比较小,所以必须充分搅拌。上述反应,只能得到含本品3.5%浓度的溶液,且碳酸锂的溶解度会由于氢氧化锂的生成而降低,并残存在碳酸钙的沉淀中而不溶解。所以,随着反应的进行,必须随时除去碳酸钙沉淀,并洗涤回收碳酸锂。除去碳酸钙沉淀后的母液,进一步减压浓缩,可析出一水合物,分离后,在130~140℃下干燥,可得一水合物。将一水合物在150~180℃下干燥,可制得无水氢氧化锂。化学性质白色单斜结晶。相对密度1.51。溶于水,微溶于酸、醇,不溶于醚。用途石油、化工、轻工、核工业等用。用于碱性蓄电池时,铝含量不大于0.06%,铅含量不大于0.01%。用途用作分析试剂、照相显影剂,也用于锂的制造用途要用作制取锂化合物的原料。也可用于冶金、石油、玻璃、陶瓷等工业用途电池级单水氢氧化锂主要用于锂离子电池正极材料的制备,同是也可做碱性蓄电池电解质的添加剂用途照相显影剂,制备锂盐,制造醇到树脂,催化剂。用于氧化物和硅酸盐分解的试剂用途有机酸的滴定。照相显影剂。制备锂盐。制造醇酸树脂。催化剂。碱性电池。生产方法石灰烧结法锂辉石精矿(一般含氧化锂6%),与石灰石混合磨细,在1150~1250℃下烧结生成铝酸锂和硅酸钙,经湿磨粉碎,用洗液浸出氢氧化锂,经沉降过滤,浸出液经蒸发浓缩,结晶生成单水氢氧化锂成品,其反应式为:Li2O+AI2O3+4SiO2+8CaO→Li2O+A12O3+4[2CaO+SiO2]Li2O+AI2O3+Ca(OH)2→2LiOH+CaO+AI2O3 |
| 结构式: |
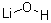 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|